Vers un nouveau traitement pour Parkinson ?
Maladie neurodégénérative affectant les neurones qui contrôlent le mouvement, la maladie de Parkinson se caractérise par des symptômes moteurs et cognitifs importants. Chercheur en neurosciences au CIRB (Centre interdisciplinaire de recherche en biologie) du Collège de France, Laurent Venance s’intéresse à la maladie de Parkinson dans le cadre de ses recherches sur la mémoire procédurale et espère ouvrir une nouvelle piste thérapeutique pour traiter cette maladie, deuxième cause en France de handicap moteur chez l’adulte.

Vous êtes docteur en neurosciences et vous travaillez au sein du CIRB au Collège de France sur un sujet énigmatique pour le profane : la mémoire procédurale et son fonctionnement. Pouvez-vous nous en dire plus ?
La mémoire procédurale, c’est tout ce qui concerne l’acquisition d’habitudes, d’automatismes : danser, faire du vélo, faire ses lacets… Notre objet d’étude principal, c’est plus précisément comment cette mémoire et son apprentissage sont encodés dans le cerveau. On s’intéresse donc à la formation des automatismes. Comment ces informations sont-elles stockées ? Comment une acquisition devient un automatisme ? Comment on le sollicite ? Comment on s’en défait ?
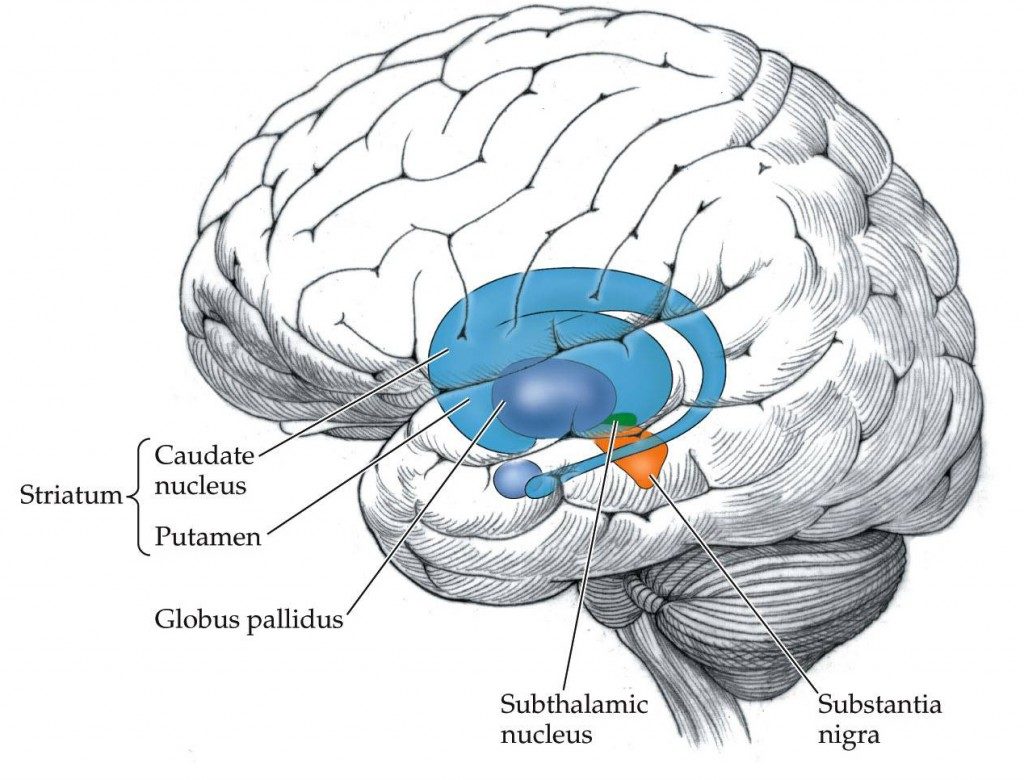
La zone du cerveau impliquée dans ces automatismes, ce sont les ganglions de la base. C’est un ensemble de cinq noyaux sous-corticaux, c’est-à-dire situés sous le cortex cérébral [NDLR : la partie en surface du cerveau], fortement interconnectés entre eux. Ils interviennent entre autres dans la planification de l’action, le contrôle du mouvement et la formation des automatismes.
| © 2010 Sinauer Associates, Inc. |
Ce que l’on sait déjà, c’est que la formation des automatismes se fait par un « apprentissage supervisé » : à chaque fois qu’une erreur n’est pas commise, un signal récompensant est délivré au niveau du cerveau pour encourager l’effort. En deux mots, on apprend par récompense interne. Ce signal récompensant, c’est la dopamine : un neuromodulateur qui se situe dans une structure assez profonde du cerveau appelée la substance noire pars compacta.
Nos travaux portent donc sur les ganglions de la base, zones « arrosées » par la dopamine, sur l’apprentissage procédural et comment celui-ci est encodé au niveau des réseaux neuronaux. On est principalement dans une recherche fondamentale. Nous collaborons notamment avec des modélisateurs du CIRB qui viennent traduire en formules mathématiques la séquence des événements que nous identifions.
Dans le cadre de cette recherche, vous vous intéressez plus particulièrement à la maladie de Parkinson, pourquoi ?
La maladie de Parkinson est une des principales pathologies des ganglions de la base et plusieurs raisons nous ont poussés à nous y intéresser en particulier. Tout d’abord, elle met en jeu la dopamine. Plus exactement, chez le malade de Parkinson, il n’y a plus de dopamine car les neurones dopaminergiques dégénèrent. L’apprentissage supervisé, en plus du contrôle du mouvement, est donc fortement atteint. De plus, nous avons la chance de bénéficier au sein de notre équipe de l’expertise de Bertrand Degos, professeur des universités et praticien hospitalier, qui est notamment médecin coordinateur du Centre Référent Maladie de Parkinson Ile-de-France. Il nous apporte une expertise clinique qui nous permet d’inscrire nos recherches dans une démarche plus concrète.
Vous vous intéressez notamment aux traitements actuellement prescrits dans le cadre de cette maladie…
Tout à fait. Quand les malades parkinsoniens commencent à développer des symptômes – d’abord moteurs puis cognitifs – on estime que plus de 70% des neurones dopaminergiques sont d’ores et déjà morts. Comme la dopamine manque, la stratégie thérapeutique est d’en fournir artificiellement. On donne donc aux patients de la L-Dopa, précurseur de la dopamine qui doit être pris plusieurs fois par jour. Ce traitement fonctionne plutôt correctement dans un premier temps. Le problème, c’est que, de manière inexorable, au bout de 5, 10 ou 15 ans, les patients montrent des signes anormaux appelés « dyskinésies L-Dopa induites » : des troubles moteurs, comme des mouvements désordonnés, extrêmement invalidants.
“Quand les malades parkinsoniens commencent à développer des symptômes (…) on estime que plus de 70% des neurones dopaminergiques sont d’ores et déjà morts.”
A l’heure actuelle, la seule technique utilisée pour pallier cet effet secondaire est la stimulation cérébrale profonde, appelée aussi « DBS ». On insère dans le cerveau des patients deux électrodes jusqu’aux substances noires et on les stimule continuellement à environ 130 hertz. Le patient ne montre alors plus de symptômes L-Dopa induits mais doit porter jour et nuit une petite batterie sous sa peau qui doit être changée tous les 6 mois. Il s’agit là d’un traitement très efficace mais qui présente l’inconvénient majeur d’être invasif et de ne profiter qu’à une minorité des patients. Ainsi, il ne bénéficie en France qu’à 8% seulement des patients parkinsoniens. Cela est dû à trois raisons. Premièrement, la personne ne doit pas être trop âgée ou trop faible car c’est une opération chirurgicale très lourde. Deuxièmement, son système cérébro-vasculaire doit être en très bon état car l’opération peut entraîner des micro-hémorragies. Enfin, il faut qu’elle soit ce qu’on appelle un « high L-Dopa responder », c’est-à-dire qu’elle ait bien réagi et supporté le traitement à la L-Dopa. C’est un vrai problème de santé publique parce que cela veut dire que beaucoup de patients sont exclus de ce traitement et sont condamnés à avoir des désordres moteurs et cognitifs lourds.
“C’est un vrai problème de santé publique parce que cela veut dire que beaucoup de patients sont exclus de ce traitement et sont condamnés à avoir des désordres moteurs et cognitifs lourds.”
L’autre problème, et qui n’est pas anecdotique, c’est que la stimulation cérébrale profonde est coûteuse. C’est donc un traitement qui ne bénéficie qu’aux seuls pays industrialisés où les conditions de vie sont très bonnes. En définitive, sur la population mondiale, très peu de patients peuvent bénéficier de ce traitement. Il y a donc urgence à trouver une alternative moins invasive et qui puisse profiter à plus de monde, et c’est dans cette perspective que s’inscrit notre projet.
Le but de votre recherche c’est donc de comprendre le fonctionnement de la stimulation cérébrale profonde (DBS) pour permettre de trouver une nouvelle solution thérapeutique ?
Exactement. En fait, la DBS a été trouvée de manière totalement empirique et son mécanisme n’est toujours pas compris, c’est un vrai mystère ! Notre stratégie est donc d’étudier ce traitement, qui est le plus efficace, de tenter d’en comprendre le fonctionnement au niveau des réseaux neuronaux, afin de pouvoir proposer une alternative thérapeutique moins invasive.
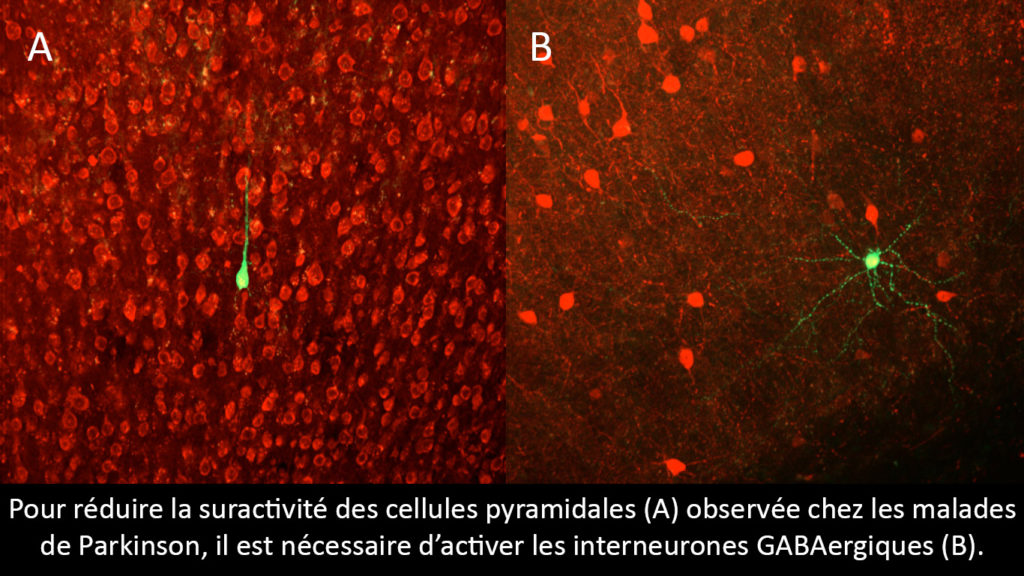
Jusqu’à maintenant, les scientifiques qui étudiaient la maladie de Parkinson ne cherchaient que ce qui avait été altéré et uniquement au sein des ganglions de la base. Ce dont nous nous sommes aperçus – un peu par hasard – c’est que la DBS agissait également sur les cellules pyramidales qui se situent pourtant au niveau du cortex cérébral, soit une toute autre zone du cerveau qui jusqu’ici n’était pas impliquée directement dans la maladie…
Les cellules pyramidales sont des neurones qui captent l’ensemble des informations du monde extérieur et qui les redistribuent vers les structures cérébrales plus profondes ; c’est une sorte d’unité centrale… Pour réduire la suractivité de ces cellules, telle qu’observée récemment dans la maladie de Parkinson, il est nécessaire d’activer ce qu’on appelle les interneurones GABAergiques. Il s’agit en quelque sorte des freins du cerveau, des inhibiteurs qui viennent calmer le système. Et cette activation des interneurones GABAergiques semble être un des modes d’action de la DBS, ce que nous cherchons à confirmer à l’aide de l’optogénétique.
L’optogénétique, c’est un nouveau champ de la biologie qui associe optique et génétique. Elle permet de rendre certains neurones sensibles à la lumière, dans des longueurs d’ondes spécifiques, grâce au génie génétique : la lumière peut dès lors être utilisée pour aller contrôler spécifiquement l’activité de tel ou tel neurone. Notre projet c’est donc de ne plus stimuler les substances noires avec la DBS mais de mobiliser directement certains interneurones GABAergiques avec de la lumière.
Mais du coup vous vous éloignez complètement de votre projet de recherche initial ?
Un peu, mais pas tout à fait. En fait, étudier la maladie de Parkinson nous permet de mieux comprendre comment fonctionne l’encodage de la mémoire procédurale. C’est par le dysfonctionnement du système qu’on en comprend le fonctionnement…
“C’est par le dysfonctionnement du système qu’on en comprend le fonctionnement…”
Revenons à vos recherches sur Parkinson, quels résultats peut-on espérer pour les malades ?
Il est encore trop tôt pour le dire… En fait, notre projet c’est de chercher à comprendre le fonctionnement de la maladie de Parkinson et de ses traitements pour nourrir nos recherches sur la mémoire procédurale ; le tout en essayant d’identifier une nouvelle cible thérapeutique qu’on pourra alors proposer aux chercheurs « cliniques » pour qu’ils puissent développer un traitement à partir de notre recherche.
En fait, vous êtes une sorte de porte d’entrée pour une recherche clinique plus ciblée et un véritable traitement ?
Oui, tout à fait. C’est de la recherche fondamentale que viennent les découvertes appliquées. En tant que chercheurs au Collège de France, on participe à l’avancée des connaissances générales de manière fondamentale et, même si les bénéfices ne se voient pas immédiatement, je pense que c’est absolument essentiel. C’est pour cela qu’il est important de soutenir la recherche fondamentale, bien qu’elle puisse parfois paraître abstraite…
Par exemple, pour le virus du Sida, si des scientifiques n’avaient pas étudié les principes fondamentaux du système immunitaire, on n’aurait pas compris « si vite » comment le virus pouvait infecter les cellules immunitaires et être aussi dévastateur. C’est la découverte des voies d’accès du virus vers notre corps qui a permis ensuite de savoir comment le bloquer… Là, modestement, en s’intéressant à des mécanismes d’encodage de la mémoire, nous étudions comment ceux-ci sont désorganisés dans la maladie de Parkinson ; ce qui peut nous amener à proposer de nouvelles pistes ou cibles thérapeutiques.
Propos recueillis par Flavie Dubois-Mazeyrie











![[VIDÉO] Comment s’arrêtent les pandémies ?](https://www.fondation-cdf.fr/wp-content/uploads/2022/04/masque-rue-480x400.jpeg)

![[VIDÉO] Agir pour l’éducation](https://www.fondation-cdf.fr/wp-content/uploads/2021/12/Capture-décran-2021-12-02-à-18.28.29-480x400.png)