Reproduire le vivant pour le réparer
3 questions à Nadine Nassif, chercheuse au Laboratoire de chimie de la matière condensée de Paris (CNRS/Sorbonne Université). Pendant plusieurs années, la Fondation du Collège de France a soutenu ses recherches au Collège de France avec le soutien de la Fondation EDF. Son équipe a récemment fait de nouvelles découvertes en morphogénèse tissulaire qui pourraient permettre de faire progresser notre connaissance de certaines maladies et malformations.
La Fondation du Collège de France et la Fondation EDF ont apporté leur soutien à votre projet de recherche. Qu’est-ce que ce financement vous a permis de mettre en place ?
Le financement de la Fondation Collège de France et de la Fondation EDF a été déterminant pour obtenir ces résultats car il m’a permis de disposer de fonds pour acheter un microscope à lumière polarisée, essentiel pour identifier les textures de biréfringence du collagène, de financer un stage post-doctoral et d’acheter des consommables. Mais il a été surtout primordial car j’ai pu effectuer tout cela au fil de l’eau selon les résultats que l’on obtenait. Cela n’est malheureusement plus possible actuellement avec les financements publics (type ANR) mis en place depuis quelques années en France où on nous demande de remplir des diagrammes de Gantt et de disserter sur les résultats attendus… La place précieuse du hasard dans les découvertes qui est pourtant au cœur de la recherche disparaît malheureusement progressivement dans un tel contexte. Nous passons plus de temps à chercher des fonds pour travailler qu’à effectuer nos travaux de recherche.
Cette confiance que m’a accordée la fondation et ainsi le temps pour “chercher” et la liberté qui en découle ont été primordiaux pour la réussite de ce travail qui est le fruit d’allers-retours entre recherches fondamentale et appliquée. Je souhaite dans ce cadre remercier sincèrement de nouveau la Fondation et spécifiquement Marie Cheron qui a porté ce projet.
Une partie de votre recherche consiste à développer des tissus « bio-inspirés » à base de collagène pour pallier aux déficiences du corps humain. A quels besoins répondent ces nouveaux matériaux ?
Mon domaine de recherche, l’ingénierie tissulaire s’intéresse aux forces biologiques, physiques et chimiques qui interviennent dans le développement des tissus, les blessures et la cicatrisation des plaies. Nous cherchons à réparer ou remplacer des tissus biologiques endommagés, ce qui nécessite d’étudier la physiologie d’un tissu sain pour comprendre son fonctionnement. Les modèles de tissus développés en laboratoire peuvent avoir de nombreuses utilisations en recherche. Par exemple, ils peuvent permettre aux chercheurs de déterminer comment certains types de tissus se forment à partir de cellules souches, et observer comment des changements d’environnement affectent le tissu en développement, étudier les maladies au niveau des tissus ou encore tester des thérapies.
Dans le cadre du projet soutenu par la Fondation, mon équipe avait pour objectif la création de tissus « bio-inspirés » à base de collagène, dans la perspective d’élaborer des implants de substituts osseux ou de cornée. Le collagène, protéine la plus abondante du règne animal, est présent dans les os, le cartilage, les muscles. Cette « colle naturelle » a pour rôle de donner aux tissus une résistance mécanique à l’étirement et contribue de façon essentielle à l’architecture des organismes. En ajustant la concentration du collagène, ces biomatériaux peuvent former des architectures similaires à celles observées dans les tissus biologiques vivants. Face à une pénurie récurrente de greffons cornéens ou à la pratique de l’autotransplantation qui implique une double opération pour le patient, ce type de recherche permet de répondre aux déficiences du corps humain et à la perte d’autonomie qu’induisent de nombreuses maladies.
Biomatériaux : vaisseaux artificiels, implants, prothèses, os ou cartilage synthétique, cœur artificiel, greffes de cellules ou de tissus… De nombreux biomatériaux sont désormais utilisés pour réparer ou régénérer le corps humain. Ces matériaux, synthétiques ou vivants, sont utilisables à des fins médicales pour remplacer une partie ou une fonction d’un organe ou d’un tissu.
En quoi consistent les récentes découvertes de votre équipe, parues dans la revue Advanced Science ?
Notre squelette est un tissu vivant remodelé tout au long de la vie. Il associe des cellules spécialisées à une trame organique consolidée par des plaquettes minérales. La trame organique est constituée en majorité de fibrilles de collagène, une protéine synthétisée par des cellules, les ostéoblastes. Ce tissu néoformé, appelé ostéoïde, évolue en un tissu mature caractérisé par l’organisation des fibrilles de collagène en 3D selon une géométrie en contreplaqué torsadé et par la présence de nanocristaux de phosphate de calcium, l’hydroxyapatite, au sein de ce réseau de fibrilles[1].
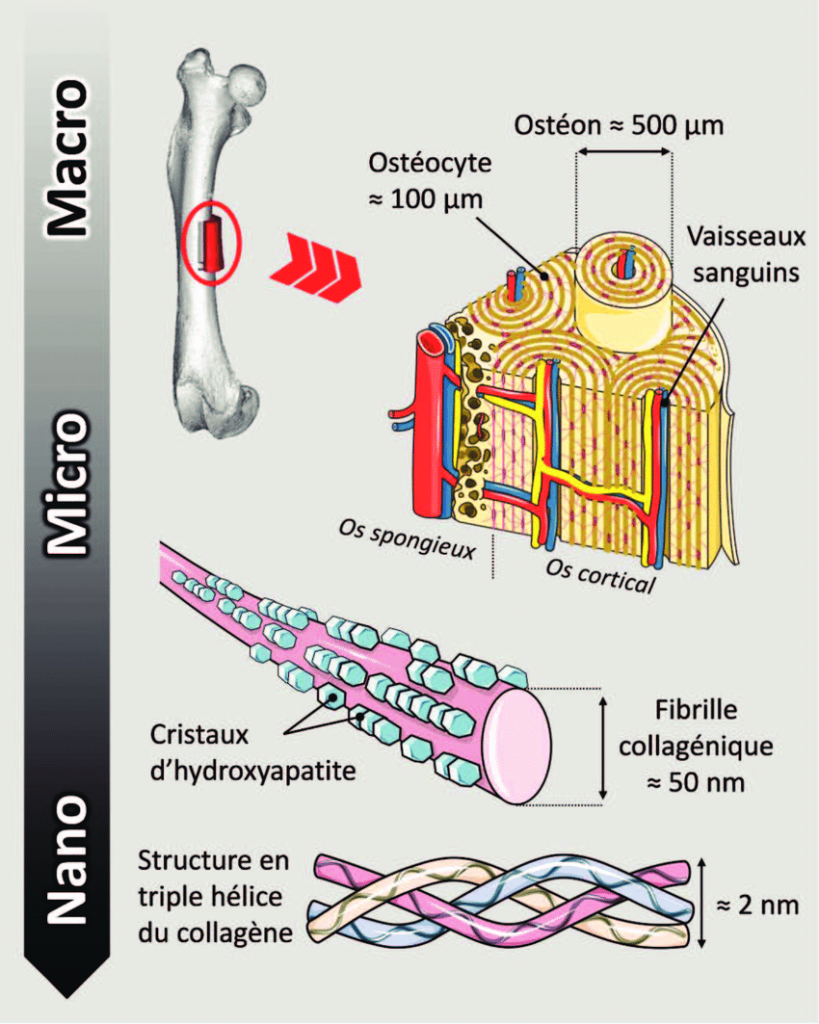
On sait peu de choses sur la façon dont les fibrilles de collagène atteignent des degrés d’organisation aussi élevés. L’hypothèse la plus ancienne et encore largement admise, est que la maturation tissulaire est entièrement contrôlée par l’activité des ostéoblastes. Des auteurs suggèrent une légère rotation du tapis cellulaire entre chaque dépôt de couche fibrillaire, aboutissant à cette architecture en contreplaqué torsadé[2].
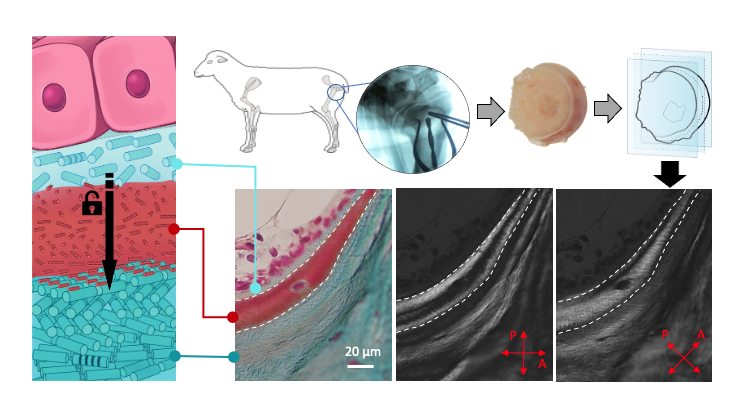
Or, grâce notamment à diverses techniques de caractérisation sur des biopsies osseuses, nous avons mis en évidence pour la première fois des domaines cristal-liquide cholestériques situés à l’interface entre le tissu néoformé et mature contenant des molécules de collagène (domaine rouge dans la figure ci-dessous) sous formes libres (c’est-à-dire non assemblées en fibrilles) compte tenu du pH acide environnant. De plus, ces domaines acides, riches en glycosaminoglycanes, établissent un gradient en ions précurseurs de l’hydroxyapatite.
Un cristal liquide est un état de la matière qui combine des propriétés d’un liquide conventionnel et celles d’un solide cristallisé. L’état cholestérique correspond à une phase de cristal liquide au cours de laquelle les molécules se positionnent et s’orientent à la manière d’une hélice.
Nos observations soulignent l’importance des cellules pendant le remodelage et la sécrétion du tissu osseux néoformé. En effet, leur activité biologique est nécessaire pour établir les conditions optimales générant l’architecture du réseau de collagène mature. Cependant, nous montrons que les cellules ne structurent pas directement la géométrie de la matrice extracellulaire par “impression 3D ” du motif de contreplaqué torsadé, au contraire, celui-ci émerge spontanément de processus physico-chimiques thermodynamiques. Ainsi, nous validons ici l’hypothèse d’Yves Bouligand faite sur l’existence d’analogues biologiques des cristaux liquides il y a 50 ans2. En effet, si l’existence de géométries « figées » semblables à celles décrites dans certains cristaux liquides était largement établie[3], un « réel » état de la matière cristal-liquide au sein des tissus biologiques n’avait jamais été démontré.
« La présence de phases cristal-liquides de collagène dans le tissu osseux implique une nouvelle compréhension des mécanismes de sa formation, ouvrant la possibilité de reproduire et de contrôler sa mise en place. »
Une forme de diagnostic d’ordre physico-chimique des pathologies osseuses devient pertinent, en complément d’approches génétiques, biochimiques et cellulaires. La caractérisation plus fine de domaines osseux pathologiques, leur composition et structure en comparaison de tissu sain, permettra, je l’espère, de progresser dans la connaissance de certaines maladies et malformations ; les zones acides de la matrice osseuse devenant des cibles potentielles de par leurs propriétés particulières, pH et structure non fibrillaire. Une thèse est en cours sur ce sujet.
« Reproduire in vitro les structures 3D du vivant »
Nous avons pu, en combinant chimie des procédés et matière molle, acquérir le savoir-faire pour reproduire in vitro par le biais des propriétés cristal-liquides du collagène de type I, ces structures 3D du vivant en effectuant un saut d’échelle en termes de taille de matériaux et en assurant la reproductibilité des agencements fibrillaires observés.
[1] Livolant et al. Biol. Cell. 1978.
[2] Yamamoto, et al. Microscopy, 2012.
[3] Mitov, Soft Matter, 2017.
Article scientifique paru dans la revue Advanced Science 2023 : Dans des biopsies osseuses, les scientifiques montrent que le collagène s’organise pour former des phases « cristal-liquide ». Grâce à ces découvertes, il est désormais possible de reproduire exactement l’organisation du collagène au sein des matrices biologiques de l’os. Cette étape incontournable ouvre la voie à de nombreuses applications dans le domaine médical.
Au Collège de France, Nadine Nassif était rattachée à la chaire Chimie des matériaux hybrides (2011-2020) du Pr Clément Sanchez.
Propos recueillis par Mathilde Lanneau



















![[VIDÉO] Comment s’arrêtent les pandémies ?](https://www.fondation-cdf.fr/wp-content/uploads/2022/04/masque-rue-480x400.jpeg)












![[VIDÉO] Regards croisés sur le défi climatique](https://www.fondation-cdf.fr/wp-content/uploads/2020/12/Image-Article-site-FCDF-480x400.png)

![[PUBLICATION] Une Boussole pour l’Après](https://www.fondation-cdf.fr/wp-content/uploads/2020/08/Couverture-Boussole-pour-Après-480x400.png)

























![[VIDÉO] Réflexions sur la vérité scientifique dans une époque trouble](https://www.fondation-cdf.fr/wp-content/uploads/2019/10/S.Haroche-conf-480x400.jpg)